CREADO POR : Johan Sebastian Urrea Rueda.
GRADO: 11-3T
ALCOHOLES
.jpg)
Los alcoholes son compuestos orgánicos formados a partir de los hidrocarburos mediante la sustitución de uno o más grupos hidroxilo por un número igual de átomos de hidrógeno. El término se hace también extensivo a diversos productos sustituidos que tienen carácter neutro y que contienen uno o más grupos alcoholes
.jpg)
Los alcoholes son compuestos orgánicos formados a partir de los hidrocarburos mediante la sustitución de uno o más grupos hidroxilo por un número igual de átomos de hidrógeno. El término se hace también extensivo a diversos productos sustituidos que tienen carácter neutro y que contienen uno o más grupos alcoholes
- USOS EN LA INDUSTRIA
Los alcoholes se utilizan como productos químicos intermedios y disolventes en las industrias de textiles, colorantes, productos químicos, detergentes, perfumes, alimentos, bebidas, cosméticos, pinturas y barnices. Algunos compuestos se utilizan también en la
desnaturalización del alcohol, en productos de limpieza, aceites y tintas de secado rápido, anticongelantes, agentes espumígenos y en la flotación de minerales.
El n-propanol es un disolvente utilizado en lacas, cosméticos, lociones dentales, tintas de impresión, lentes de contacto y líquidos de frenos. También sirve como antiséptico, aromatizante sintético de bebidas no alcohólicas y alimentos, producto químico intermedio y desinfectante. El isopropanol es otro disolvente industrial importante que se utiliza como anticongelante, en aceites y tintas de secado rápido, en la desnaturalización de alcoholes
y en perfumes. Se emplea como antiséptico y sustitutivo del alcohol etílico en cosméticos (p. ej. lociones para la piel, tónicos capilares y alcohol para fricciones), pero no puede utilizarse en productos farmacéuticos aplicados internamente. El isopropanol es un ingrediente de jabones líquidos, limpiacristales, aromatizante sintético de bebidas no alcohólicas y alimentos y producto químico intermedio.
El n-butanol se emplea como disolvente de pinturas, lacas, barnices, resinas naturales y sintéticas, gomas, aceites vegetales, tintes y alcaloides. Se utiliza como sustancia intermedia en la fabricación de productos químicos y farmacéuticos, y en las industrias de cuero artificial, textiles, gafas de seguridad, pastas de caucho, barnices de laca, impermeables, películas fotográficas y perfumes. El sec-butanol se utiliza también como disolvente y producto químico intermedio, y se encuentra en líquidos hidráulicos de frenos, limpiadores industriales, abrillantadores, decapantes de pinturas, agentes de flotación para minerales, esencias de frutas, perfumes y colorantes.
El isobutanol , un disolvente para revestimientos de superficie y adhesivos, se emplea en lacas, decapantes de pinturas, perfumes, productos de limpieza y líquidos hidráulicos. El terc-butanol se utiliza para la eliminación del agua de los productos, como disolvente en la fabricación de fármacos, perfumes y aromas, y como producto químico intermedio. También es un ingrediente de productos industriales de alcohol, un desnaturalizante de alcoholes y un cebador de octano en gasolinas. Los alcoholes amílicos actúan como espumígenos en la flotación de minerales. Muchos alcoholes, entre ellos el alcohol metilamílico, 2-etilbutanol, 2 etilhexanol, ciclohexanol, 2-octanol y metilciclohexanol, se utilizan en la fabricación de lacas. Además de sus numerosas aplicaciones como disolventes, el ciclohexanol y el metilciclohexanol son también útiles en la industria textil. El ciclohexanol se utiliza en el acabado de tejidos, el procesado del cuero y como homogeneizador de jabones y emulsiones detergentes sintéticas. El metilciclohexanol es un componente de productos quitamanchas a base de jabón y un agente de mezcla en jabones y detergentes para tejidos especiales. El alcohol bencílico se utiliza en la preparación de perfumes, productos farmacéuticos, cosméticos, colorantes, tintas y ésteres bencílicos. Sirve también como disolvente de lacas, plastificante y desengrasante en productos para la limpieza de alfombras. El 2-cloroetanol se emplea como agente de limpieza y disolvente de éteres de celulosa.
El isobutanol , un disolvente para revestimientos de superficie y adhesivos, se emplea en lacas, decapantes de pinturas, perfumes, productos de limpieza y líquidos hidráulicos. El terc-butanol se utiliza para la eliminación del agua de los productos, como disolvente en la fabricación de fármacos, perfumes y aromas, y como producto químico intermedio. También es un ingrediente de productos industriales de alcohol, un desnaturalizante de alcoholes y un cebador de octano en gasolinas. Los alcoholes amílicos actúan como espumígenos en la flotación de minerales. Muchos alcoholes, entre ellos el alcohol metilamílico, 2-etilbutanol, 2 etilhexanol, ciclohexanol, 2-octanol y metilciclohexanol, se utilizan en la fabricación de lacas. Además de sus numerosas aplicaciones como disolventes, el ciclohexanol y el metilciclohexanol son también útiles en la industria textil. El ciclohexanol se utiliza en el acabado de tejidos, el procesado del cuero y como homogeneizador de jabones y emulsiones detergentes sintéticas. El metilciclohexanol es un componente de productos quitamanchas a base de jabón y un agente de mezcla en jabones y detergentes para tejidos especiales. El alcohol bencílico se utiliza en la preparación de perfumes, productos farmacéuticos, cosméticos, colorantes, tintas y ésteres bencílicos. Sirve también como disolvente de lacas, plastificante y desengrasante en productos para la limpieza de alfombras. El 2-cloroetanol se emplea como agente de limpieza y disolvente de éteres de celulosa.
El etanol es la materia prima de numerosos productos, como acetaldehído, éter etílico y cloroetano. Se utiliza como anticongelante, aditivo alimentario y medio de crecimiento de levaduras, en la fabricación de revestimientos de superficie y en la preparación de mezclas de gasolina y alcohol etílico. La producción de butadieno a partir de alcohol etílico ha tenido una gran importancia en las industrias de los plásticos y el caucho sintético. El alcohol etílico puede disolver muchas sustancias y, por este motivo, se utiliza como disolvente en la fabricación de fármacos, plásticos, lacas, barnices, plastificantes, perfumes, cosméticos,
aceleradores del caucho, etc.
El metanol es un disolvente de tintas, colorantes, resinas y adhesivos. Se utiliza en la fabricación de película fotográfica, plásticos, jabones textiles, tintes de madera, tejidos con capa de resina sintética, cristal inastillable y productos impermeabilizantes. Sirve
como materia prima para la fabricación de muchos productos químicos y es un ingrediente de decapantes de pinturas y barnices, productos desengrasantes, líquidos embalsamadores y
mezclas anticongelantes. El pentanol se utiliza en la fabricación de lacas, pinturas, barnices, decapantes, caucho, plásticos, explosivos, líquidos hidráulicos, pegamentos para calzado, perfumes, productos químicos y farmacéuticos, y en la extracción de grasas. Cuando se utilizan como disolventes, sirven perfectamente las mezclas de alcoholes, pero para síntesis químicas o extracciones más selectivas se requieren a menudo productos más puros. Después del cloruro de alilo, el alcohol alílico es el compuestos alílico más importante en la industria. Se utiliza en la fabricación de productos farmacéuticos y en síntesis químicas en general, pero sobre todo para la producción de una serie de ésteres alílicos, los más importantes de los cuales son el ftalato de dialilo y el isoftalato de dialilo, que sirven de monómeros y repolímeros.
Propiedades de los alcoholes
Los alcoholes son compuestos que presentan en la cadena carbonada uno o más grupos hidroxi u oxidrilo (-OH).
- Propiedades Físicas:
El grupo –OH es muy polar y, lo que es más importante, es capaz de establecer puentes de hidrógeno: con sus moléculas compañeras o con otras moléculas neutras.
- Solubilidad:
Puentes de hidrógeno: La formación de puentes de hidrógeno permite la asociación entre las moléculas de alcohol. Los puentes de hidrógeno se forman cuando los oxígenos unidos al hidrógeno en los alcoholes forman uniones entre sus moléculas y las del agua. Esto explica la solubilidad del metanol, etanol, 1-propanol, 2-propanol y 2 metil-2-propanol.

alcohol-alcohol
alcohol-agua
A partir de 4 carbonos en la cadena de un alcohol, su solubilidad disminuye rápidamente en agua, porque el grupo hidroxilo (–OH), polar, constituye una parte relativamente pequeña en comparación con la porción hidrocarburo. A partir del hexanol son solubles solamente en solventes orgánicos.
1 propanol
Hexanol
Existen alcoholes de cuatro átomos de carbono que son solubles en agua, debido a la disposición espacial de la molécula. Se trata de moléculas simétricas.
2-metil-2-propanol
Existen alcoholes con múltiples moléculas de OH (polihidroxilados) que poseen mayor superficie para formar puentes de hidrógeno, lo que permiten que sean bastante solubles en agua.
1,2,3 propanotriol (glicerina)
Punto de Ebullición: Los puntos de ebullición de los alcoholes también son influenciados por la polaridad del compuesto y la cantidad de puentes de hidrógeno. Los grupos OH presentes en un alcohol hacen que su punto de ebullición sea más alto que el de los hidrocarburos de su mismo peso molecular. En los alcoholes el punto de ebullición aumenta con la cantidad de átomos de carbono y disminuye con el aumento de las ramificaciones.
El punto de fusión aumenta a medida que aumenta la cantidad de carbonos.
Densidad: La densidad de los alcoholes aumenta con el número de carbonos y sus ramificaciones. Es así que los alcoholes alifáticos son menos densos que el agua mientras que los alcoholes aromáticos y los alcoholes con múltiples moléculas de –OH, denominados polioles, son más densos.
(Constantes Físicas de algunos alcoholes)
|

- Propiedades Químicas:
Los alcoholes pueden comportarse como ácidos o bases, esto gracias al efecto inductivo, que no es más que el efecto que ejerce la molécula de –OH como sustituyente sobre los carbonos adyacentes. Gracias a este efecto se establece un dipolo.
La estructura del alcohol está relacionada con su acidez. Los alcoholes, según su estructura pueden clasificarse como metanol, el cual presenta un sólo carbono, alcoholes primarios, secundarios y terciarios que presentan dos o más moléculas de carbono.
| Alcohol Terciario | 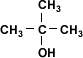 | 2-metil-2-propanol |
| Alcohol Secundario | 2-butanol | |
| Alcohol Primario | 1-butanol | |
| Metanol |
Metanol > alcohol primario > alcohol secundario > alcohol terciario(>: mayor acidez)
Debido a que en el metanol y en los alcoholes primarios el hidrógeno está menos firmemente unido al oxígeno, la salida de los protones de la molécula es más fácil por lo que la acidez será mayor en el metanol y el alcohol primario.
Deshidratación: la deshidratación de los alcoholes se considera una reacción de eliminación, donde el alcohol pierde su grupo –OH para dar origen a un alqueno. Aquí se pone de manifiesto el carácter básico de los alcoholes. La reacción ocurre en presencia de ácido sulfúrico (H2SO4) en presencia de calor.

La deshidratación es posible ya que el alcohol acepta un protón del ácido, para formar el alcohol protonado o ión alquil hidronio.
El alcohol protonado pierde una molécula de agua y forma un ión alquil-carbonio:


El ión alquil-carbonio pierde un protón lo que regenera la molécula de ácido sulfúrico y se establece el doble enlace de la molécula a la cual está dando origen el alcohol.
El calentamiento de un alcohol en presencia de ácido sulfúrico a temperaturas inferiores a las necesarias para obtener alquenos producirá otros compuestos como éteres y ésteres.
Obtención de alcoholes: al igual que a partir de los alcoholes se pueden obtener otros compuestos, los alcoholes pueden ser obtenidos a partir de hidratación o hidroboración – oxidación de alquenos, o mediante hidrólisis de halogenuros de alquilo. Para la obtención de alcoholes por hidratación de alquenos se utiliza el ácido sulfúrico y el calor.

La hidroboración: (adición de borano R3B) de alqueno en presencia de peróxido de hidrógeno (H2O2) en medio alcalino da origen a un alcohol.


La hidrólisis: de halogenuros de alquilo o aralquilo se produce en presencia de agua y hidróxidos fuertes que reaccionan para formar alcoholes.
En la industria la producción de alcoholes se realiza a través de diversas reacciones como las ya mencionadas, sin embargo se busca que éstas sean rentables para proporcionar la máxima cantidad de producto al menor costo. Entre las técnicas utilizadas por la industria para la producción de alcoholes se encuentra la fermentación donde la producción de ácido butírico a partir de compuestos azucarados por acción de bacterias como el Clostridium butycum dan origen al butanol e isopropanol. Para la producción de alcoholes superiores en la industria la fermentación permite la producción de alcoholes isoamílico, isobutílico y n-propílico a partir de aminoácidos. Es así como la industria utiliza los procesos metabólicos de ciertas bacterias para producir alcoholes.
- USOS DEL ALCOHOL
EL METANOL: Es muy toxico, su ingestión puede causar ceguera y hasta la muerte. Es un combustible de alto rendimiento por lo que se lo usa como combustible de autos de carreras.Pero como combustible es menos conocido que el etanol debido a sus altos costos.
EL ETANOL: Es un líquido muy volátil y constituye la materia prima de numerosas industrias de licores,perfumes,cosmèticos y jarabes .También se usa como combustible y desinfectante .
EL PROPANOL: Se utiliza como un antiséptico aún más eficaz que el alcohol etílico; su uso mas común es en forma de quita esmalte oremovedor .Disolvente para lacas, resinas, revestimientos y ceras. También para la fabricación de líquido de frenos, ácidopropiónico y plastificadores.
riesgos para la salud metanol:
entre los muchos procesos de síntesis que existen para la producción de alcohol metílico se encuentra la reacción de fischertropsch entre el monóxido de carbono y el hidrógeno, de la que se obtiene metanol como subproducto. también se produce mediante la oxidación directa de hidrocarburos o mediante un proceso de hidrogenación en dos etapas en el que se hidrogena el monóxido de carbono para dar formiato de metilo, que a su vez se hidrogena para obtener alcohol metílico. sin embargo, la síntesis más importante es la realizada mediante hidrogenación catalítica a presión del monóxido de carbono o del dióxido decarbono, a presiones de 100-600 kgf/cm2 y temperaturas de 250-400 ºc. el alcohol metílico tiene propiedades tóxicas que pueden hacerse evidentes tanto por exposición aguda como crónica.
los alcohólicos que ingieren este líquido o los trabajadores que inhalan sus vapores pueden sufrir lesiones. en experimentos con animales se ha demostrado que el alcohol metílico puede penetrar en la piel en cantidad suficiente como para causar una intoxicación mortal. en casos de intoxicación grave, generalmente por ingestión, el alcohol metílico actúa de forma específica en el nervio óptico, causando ceguera como resultado de la degeneración del nervio óptico, acompañada de cambios degenerativos en las células ganglionares de la retina y trastornos circulatorios en la coroides.
la ambliopía es normalmente bilateral y puede aparecer pocas horas después de la ingestión, mientras que la ceguera total no se instaura hasta pasada una semana. las pupilas aparecen dilatadas, la esclerótica congestionada y el iris está pálido y presenta escotoma central; las funciones respiratorias y cardiovasculares están deprimidas y, en los casos muy graves, el paciente está inconsciente, si bien el coma puede ir precedido de delirio. las consecuencias de la exposición industrial a los vapores de alcohol metílico pueden variar considerablemente de un trabajador a otro. bajo diferentes condiciones de intensidad y duración de la exposición, los síntomas de la intoxicación son: irritación de las mucosas, cefalea, zumbido de oídos, vértigo, insomnio, nistagmo, dilatación de las pupilas, visión borrosa, náuseas, vómitos, cólicos y estreñimiento. pueden producirse lesiones cutáneas por la acción irritante y disolvente del alcohol metílico y también por la acción lesiva de los tintes y resinas disueltas en él.estas lesiones se localizan preferentemente en las manos, las muñecas y los antebrazos. no obstante, la causa de estos efectos perjudiciales se debe en general a exposiciones prolongadas a concentraciones muy superiores a los límites recomendados porlas autoridades para prevenir la intoxicación por inhalación de vapores de alcohol metílico.se ha sugerido que la exposición crónica combinada a metanol y monóxido de carbono es un factor causante de aterosclerosis cerebral.la acción tóxica del alcohol metílico se atribuye a oxidación metabólica en ácido fórmico o formaldehído, producto éste que tiene un efecto nocivo específico en el sistema nervioso, y posiblemente a acidosis grave. estos procesos de oxidación pueden ser inhibidos por el alcohol etílico.
etanol:
un riesgo industrial frecuente es la exposición a vapores en la proximidad de un proceso en el que se utiliza alcohol etílico.la exposición prolongada a concentraciones superiores a 5.000 ppm causa irritación de los ojos y la nariz, cefalea, sopor, fatiga y narcosis. el alcohol etílico se oxida muy rápidamente en el organismo a dióxido de carbono y agua. el alcohol no oxidado se excreta en la orina y en el aire espirado, de manera que apenas se producen efectos acumulativos. su efecto en la piel es similar al de todos los disolventes de grasas y, de no tomarse las debidas precauciones, puede producirse una dermatitis de contacto. recientemente se ha sospechado la existencia de otro riesgo potencial en las personas expuestas a etanol sintético, por haberse demostrado que este producto es cancerígeno en ratones tratados con dosis altas. un estudio epidemiológico posterior ha revelado una mayor incidencia de cáncer de laringe (cinco veces superior a la prevista) en un grupo de trabajadores empleados en unafábrica de etanol obtenido mediante ácidos fuertes. parece ser que el agente causal fue el sulfato de dietilo, aunque también estaban implicados las alquil sulfonas y otros posiblescancerígenos. el alcohol etílico es un líquido inflamable y sus vapores forman mezclas inflamables y explosivas con el aire a temperatura ambiente. una solución acuosa con un 30 % de alcohol puede producir una mezcla inflamable de vapor y aire a 29 ºc. otra que contenga solamente un 5 % de alcohol puede producirla a 62 ºc.la ingestión es poco probable en el entorno industrial, pero posible en el caso de los alcohólicos.
el peligro de este consumo anómalo depende de la concentración de etanol, que si es superior al 70 % puede producir lesiones esofágicas y gástricas, y de la presencia de desnaturalizantes. estos últimos se añaden para hacer que el alcohol tenga un sabor desagradable cuando se obtiene libre de impuestos para fines distintos al del consumo.muchos de estos desnaturalizantes (p. ej. alcohol metílico, benceno, bases de piridina, metilisobutilcetona, queroseno, acetona, gasolina, dietilftalato, etc.) son más peligrosos para la persona que lo consuma que el propio alcohol etílico. por todo ello es muy importante asegurarse de que no se produce consumo ilegal de alcohol etílico destinado a usos industriales.
n-propanol:
no se han notificado casos de intoxicación relacionados con el uso industrial de n-propanol. para los animales de experimentación es moderadamente tóxico cuando se administra por vías respiratoria, oral o percutánea. irrita las mucosas y deprime el sistema nervioso central. cuando se inhala, produce una leve irritación del aparato respiratorio y ataxia. es algo más tóxico que el alcohol isopropílico, pero aparentemente provoca los mismos efectos biológicos. se conoce un caso de fallecimiento por ingestión de 400 ml de n-propanol. los cambios morfopatológicos observados fueron principalmente edema cerebral y pulmonar,también presentes con frecuencia en la intoxicación etílica. el n-propanol es inflamable y representa un riesgo moderado de incendio.
otros compuestos:
el isopropanol es ligeramente tóxico para los animales de experimentación cuando se administra por vía dérmica y moderadamente tóxico por vía oral e intraperitoneal. no se conoce ningún caso de intoxicación industrial, aunque sí se ha detectado unamayor incidencia de cánceres de senos nasales y laringe en trabajadores que participaban en la producción de alcohol isopropílico.
la causa podría ser el contacto con aceite isopropílico, que se obtiene como subproducto. la experiencia clínica demuestra que el alcohol isopropílico es más tóxico que el etanol, peromenos que el metanol. el isopropanol se metaboliza en el organismo dando acetona, que puede alcanzar concentraciones elevadas y, a su vez, es metabolizada y se excretada por losriñones y los pulmones. en el ser humano, las concentraciones de 400 ppm producen irritación leve de ojos, nariz y garganta. el curso clínico de la intoxicación por isopropanol es semejante al de la intoxicación por etanol. la ingestión de hasta 20 ml diluidos en agua causa solamente una suave sensación de calor y un ligero descenso de la presión sanguínea. no obstante, en dos casos mortales de intoxicación aguda, unas horas después de laingestión se produjo parada respiratoria, coma profundo e hipotensión, lo que se considera un signo de mal pronóstico. el isopropanol es un líquido inflamable que conlleva peligro deincendio.el n-butanol es potencialmente más tóxico que cualquiera de sus homólogos inferiores, pero los riesgos prácticos asociados a su producción industrial y a su uso a temperatura ambiente son muy pequeños debido a su escasa volatilidad. las altas concentraciones de vapor producen narcosis y muerte en los animales. la exposición del ser humano a los vapores puede causar irritación de las mucosas. las concentraciones que producen irritaciónvarían entre 50 y 200 ppm. con más de 200 ppm pueden presentarse edema leve transitorio ocular de la conjuntiva y un recuento de eritrocitos ligeramente reducido. el contacto del líquido con la piel provoca irritación, dermatitis y absorción. es ligeramente tóxico cuando se ingiere y conlleva también peligro de incendio. la reacción de los animales a los vapores de sec-butanol es similar a la observada con n-butanol, si bien el primero es más narcótico y letal. es un líquido inflamable con peligro de incendio.a elevadas concentraciones, la acción de los vapores de isobutanol es principalmente narcótica, como también ocurre con otros alcoholes. produce irritación ocular cuando la concentración supera los 100 ppm. el contacto del líquido con la piel puede causar eritema. es ligeramente tóxico por ingestión. es un líquido inflamable con peligro de incendio.si bien los vapores de terc-butanol son más narcóticos que los del n - o isobutanol para el ratón, hasta ahora se han notificado pocos casos de intoxicación relacionados con su uso industrial, salvo una leve irritación ocasional de la piel. es ligeramente tóxico por ingestión. además, es inflamable y constituye un riesgo importante de incendio. la exposición prolongada a vapor de ciclohexanol puede producir cefalea e irritación de la conjuntiva, aunque no existen riesgos industriales graves. a una concentración de 100 ppmproduce irritación de ojos, nariz y garganta. el contacto prolongado del líquido con la piel causa irritación, y el líquido se absorbe lentamente a través de la piel. es ligeramente tóxicocuando se ingiere. el ciclohexanol se excreta en la orina, conjugado con ácido glucurónico. el líquido es inflamable y entraña un peligro moderado de incendio. la exposición prolongada a los vapores de metilciclohexanol puede causar cefalea e irritación de los ojos y del tracto respiratorio superior. el contacto prolongado del líquido con la piel produce irritación, y el líquido se absorbe lentamente a través de la piel. es ligeramente tóxico por ingestión y se excreta en la orina, conjugado con ácido glucurónico. conlleva un peligro moderado de incendio. la exposición a vapores altamente concentrados de una mezcla que contenía alcohol bencílico, benceno y ésteres como disolvente sólo produjo cefalea, vértigo, náuseas, diarrea y pérdida de peso, todos ellos pasajeros, sin que se haya producido ningún caso de enfermedad industrial relacionado con el alcohol bencílico. esta sustancia produce una leve irritación de la piel y un leve lagrimeo. el líquido es inflamable y conlleva un peligro moderado de incendio. el alcohol alílico es un líquido inflamable e irritante. causa irritación en contacto con la piel, y la absorción a través de la piel da lugar a un dolor profundo en la región donde se ha producido la absorción, además de lesiones sistémicas. si el líquido penetra en los ojos, puede producir quemaduras graves. los vapores no poseen propiedades narcóticas serias, pero ejercen un efecto irritante sobre las mucosas y el sistema respiratorio cuando se inhalan como contaminante atmosférico. su presencia en una atmósfera industrial puede causar lagrimeo, dolor en los ojos y visión borrosa (necrosis de la córnea, hematuria y nefritis).
alcoholes amílicos:
los alcoholes pentílicos se presentan en varias formas isoméricas, y de las ocho estructuras isoméricas posibles, tres de ellas tienen también formas ópticamente activas. de las formas estructurales, cuatro de ellas son alcoholes primarios— 1-pentanol (alcohol amílico), 2-metil-1-butanol, alcohol isopentílico (3-metil-1-butanol, alcohol isoamílico) y alcohol neopentílico (2,2-dimetil-1-propanol); tres son alcoholes secundarios— 2-pentanol, 3-pentanol y 3-metil-2-butanol; y el último es un alcohol terciario—el alcohol terc-pentílico (2-metil-2-butanol).
el alcohol pentílico irrita las mucosas de los ojos, la nariz y la garganta cuando alcanza concentraciones de 100 ppm. si bien se absorbe por vía digestiva, respiratoria y cutánea, la incidencia de enfermedades profesionales es muy baja. el producto crudo causa rápidamente irritación de las mucosas debido a la presencia de materiales volátiles extraños. los síntomas de enfermedad generalizada son cefalea, mareo, náuseas, vómitos, diarrea, delirio y narcosis. el hecho de que el alcohol pentílico se utilice con frecuencia en estado impuro y mezclado con otros disolventes, hace imposible atribuir a este alcohol síntomas o hallazgos distintivos. la facilidad con la que se metabolizan los alcoholes decrece de los alcoholes primarios a los secundarios y terciarios. de los tres, los alcoholes terciarios son los que más se excretan sin sufrir cambios. aunque la toxicidad varía según la configuración química, puede afirmarse, en términos generales, que una mezcla de alcoholes pentílicos es aproximadamente diezveces más tóxica que el alcohol etílico. este hecho se refleja en los límites de exposición recomendados para los dos alcoholes—100 ppm y 1.000 ppm, respectivamente. el riesgo de incendio de los alcoholes amílicos no es particularmente elevado.
entre los muchos procesos de síntesis que existen para la producción de alcohol metílico se encuentra la reacción de fischertropsch entre el monóxido de carbono y el hidrógeno, de la que se obtiene metanol como subproducto. también se produce mediante la oxidación directa de hidrocarburos o mediante un proceso de hidrogenación en dos etapas en el que se hidrogena el monóxido de carbono para dar formiato de metilo, que a su vez se hidrogena para obtener alcohol metílico. sin embargo, la síntesis más importante es la realizada mediante hidrogenación catalítica a presión del monóxido de carbono o del dióxido decarbono, a presiones de 100-600 kgf/cm2 y temperaturas de 250-400 ºc. el alcohol metílico tiene propiedades tóxicas que pueden hacerse evidentes tanto por exposición aguda como crónica.
los alcohólicos que ingieren este líquido o los trabajadores que inhalan sus vapores pueden sufrir lesiones. en experimentos con animales se ha demostrado que el alcohol metílico puede penetrar en la piel en cantidad suficiente como para causar una intoxicación mortal. en casos de intoxicación grave, generalmente por ingestión, el alcohol metílico actúa de forma específica en el nervio óptico, causando ceguera como resultado de la degeneración del nervio óptico, acompañada de cambios degenerativos en las células ganglionares de la retina y trastornos circulatorios en la coroides.
la ambliopía es normalmente bilateral y puede aparecer pocas horas después de la ingestión, mientras que la ceguera total no se instaura hasta pasada una semana. las pupilas aparecen dilatadas, la esclerótica congestionada y el iris está pálido y presenta escotoma central; las funciones respiratorias y cardiovasculares están deprimidas y, en los casos muy graves, el paciente está inconsciente, si bien el coma puede ir precedido de delirio. las consecuencias de la exposición industrial a los vapores de alcohol metílico pueden variar considerablemente de un trabajador a otro. bajo diferentes condiciones de intensidad y duración de la exposición, los síntomas de la intoxicación son: irritación de las mucosas, cefalea, zumbido de oídos, vértigo, insomnio, nistagmo, dilatación de las pupilas, visión borrosa, náuseas, vómitos, cólicos y estreñimiento. pueden producirse lesiones cutáneas por la acción irritante y disolvente del alcohol metílico y también por la acción lesiva de los tintes y resinas disueltas en él.estas lesiones se localizan preferentemente en las manos, las muñecas y los antebrazos. no obstante, la causa de estos efectos perjudiciales se debe en general a exposiciones prolongadas a concentraciones muy superiores a los límites recomendados porlas autoridades para prevenir la intoxicación por inhalación de vapores de alcohol metílico.se ha sugerido que la exposición crónica combinada a metanol y monóxido de carbono es un factor causante de aterosclerosis cerebral.la acción tóxica del alcohol metílico se atribuye a oxidación metabólica en ácido fórmico o formaldehído, producto éste que tiene un efecto nocivo específico en el sistema nervioso, y posiblemente a acidosis grave. estos procesos de oxidación pueden ser inhibidos por el alcohol etílico.
etanol:
un riesgo industrial frecuente es la exposición a vapores en la proximidad de un proceso en el que se utiliza alcohol etílico.la exposición prolongada a concentraciones superiores a 5.000 ppm causa irritación de los ojos y la nariz, cefalea, sopor, fatiga y narcosis. el alcohol etílico se oxida muy rápidamente en el organismo a dióxido de carbono y agua. el alcohol no oxidado se excreta en la orina y en el aire espirado, de manera que apenas se producen efectos acumulativos. su efecto en la piel es similar al de todos los disolventes de grasas y, de no tomarse las debidas precauciones, puede producirse una dermatitis de contacto. recientemente se ha sospechado la existencia de otro riesgo potencial en las personas expuestas a etanol sintético, por haberse demostrado que este producto es cancerígeno en ratones tratados con dosis altas. un estudio epidemiológico posterior ha revelado una mayor incidencia de cáncer de laringe (cinco veces superior a la prevista) en un grupo de trabajadores empleados en unafábrica de etanol obtenido mediante ácidos fuertes. parece ser que el agente causal fue el sulfato de dietilo, aunque también estaban implicados las alquil sulfonas y otros posiblescancerígenos. el alcohol etílico es un líquido inflamable y sus vapores forman mezclas inflamables y explosivas con el aire a temperatura ambiente. una solución acuosa con un 30 % de alcohol puede producir una mezcla inflamable de vapor y aire a 29 ºc. otra que contenga solamente un 5 % de alcohol puede producirla a 62 ºc.la ingestión es poco probable en el entorno industrial, pero posible en el caso de los alcohólicos.
el peligro de este consumo anómalo depende de la concentración de etanol, que si es superior al 70 % puede producir lesiones esofágicas y gástricas, y de la presencia de desnaturalizantes. estos últimos se añaden para hacer que el alcohol tenga un sabor desagradable cuando se obtiene libre de impuestos para fines distintos al del consumo.muchos de estos desnaturalizantes (p. ej. alcohol metílico, benceno, bases de piridina, metilisobutilcetona, queroseno, acetona, gasolina, dietilftalato, etc.) son más peligrosos para la persona que lo consuma que el propio alcohol etílico. por todo ello es muy importante asegurarse de que no se produce consumo ilegal de alcohol etílico destinado a usos industriales.
n-propanol:
no se han notificado casos de intoxicación relacionados con el uso industrial de n-propanol. para los animales de experimentación es moderadamente tóxico cuando se administra por vías respiratoria, oral o percutánea. irrita las mucosas y deprime el sistema nervioso central. cuando se inhala, produce una leve irritación del aparato respiratorio y ataxia. es algo más tóxico que el alcohol isopropílico, pero aparentemente provoca los mismos efectos biológicos. se conoce un caso de fallecimiento por ingestión de 400 ml de n-propanol. los cambios morfopatológicos observados fueron principalmente edema cerebral y pulmonar,también presentes con frecuencia en la intoxicación etílica. el n-propanol es inflamable y representa un riesgo moderado de incendio.
otros compuestos:
el isopropanol es ligeramente tóxico para los animales de experimentación cuando se administra por vía dérmica y moderadamente tóxico por vía oral e intraperitoneal. no se conoce ningún caso de intoxicación industrial, aunque sí se ha detectado unamayor incidencia de cánceres de senos nasales y laringe en trabajadores que participaban en la producción de alcohol isopropílico.
la causa podría ser el contacto con aceite isopropílico, que se obtiene como subproducto. la experiencia clínica demuestra que el alcohol isopropílico es más tóxico que el etanol, peromenos que el metanol. el isopropanol se metaboliza en el organismo dando acetona, que puede alcanzar concentraciones elevadas y, a su vez, es metabolizada y se excretada por losriñones y los pulmones. en el ser humano, las concentraciones de 400 ppm producen irritación leve de ojos, nariz y garganta. el curso clínico de la intoxicación por isopropanol es semejante al de la intoxicación por etanol. la ingestión de hasta 20 ml diluidos en agua causa solamente una suave sensación de calor y un ligero descenso de la presión sanguínea. no obstante, en dos casos mortales de intoxicación aguda, unas horas después de laingestión se produjo parada respiratoria, coma profundo e hipotensión, lo que se considera un signo de mal pronóstico. el isopropanol es un líquido inflamable que conlleva peligro deincendio.el n-butanol es potencialmente más tóxico que cualquiera de sus homólogos inferiores, pero los riesgos prácticos asociados a su producción industrial y a su uso a temperatura ambiente son muy pequeños debido a su escasa volatilidad. las altas concentraciones de vapor producen narcosis y muerte en los animales. la exposición del ser humano a los vapores puede causar irritación de las mucosas. las concentraciones que producen irritaciónvarían entre 50 y 200 ppm. con más de 200 ppm pueden presentarse edema leve transitorio ocular de la conjuntiva y un recuento de eritrocitos ligeramente reducido. el contacto del líquido con la piel provoca irritación, dermatitis y absorción. es ligeramente tóxico cuando se ingiere y conlleva también peligro de incendio. la reacción de los animales a los vapores de sec-butanol es similar a la observada con n-butanol, si bien el primero es más narcótico y letal. es un líquido inflamable con peligro de incendio.a elevadas concentraciones, la acción de los vapores de isobutanol es principalmente narcótica, como también ocurre con otros alcoholes. produce irritación ocular cuando la concentración supera los 100 ppm. el contacto del líquido con la piel puede causar eritema. es ligeramente tóxico por ingestión. es un líquido inflamable con peligro de incendio.si bien los vapores de terc-butanol son más narcóticos que los del n - o isobutanol para el ratón, hasta ahora se han notificado pocos casos de intoxicación relacionados con su uso industrial, salvo una leve irritación ocasional de la piel. es ligeramente tóxico por ingestión. además, es inflamable y constituye un riesgo importante de incendio. la exposición prolongada a vapor de ciclohexanol puede producir cefalea e irritación de la conjuntiva, aunque no existen riesgos industriales graves. a una concentración de 100 ppmproduce irritación de ojos, nariz y garganta. el contacto prolongado del líquido con la piel causa irritación, y el líquido se absorbe lentamente a través de la piel. es ligeramente tóxicocuando se ingiere. el ciclohexanol se excreta en la orina, conjugado con ácido glucurónico. el líquido es inflamable y entraña un peligro moderado de incendio. la exposición prolongada a los vapores de metilciclohexanol puede causar cefalea e irritación de los ojos y del tracto respiratorio superior. el contacto prolongado del líquido con la piel produce irritación, y el líquido se absorbe lentamente a través de la piel. es ligeramente tóxico por ingestión y se excreta en la orina, conjugado con ácido glucurónico. conlleva un peligro moderado de incendio. la exposición a vapores altamente concentrados de una mezcla que contenía alcohol bencílico, benceno y ésteres como disolvente sólo produjo cefalea, vértigo, náuseas, diarrea y pérdida de peso, todos ellos pasajeros, sin que se haya producido ningún caso de enfermedad industrial relacionado con el alcohol bencílico. esta sustancia produce una leve irritación de la piel y un leve lagrimeo. el líquido es inflamable y conlleva un peligro moderado de incendio. el alcohol alílico es un líquido inflamable e irritante. causa irritación en contacto con la piel, y la absorción a través de la piel da lugar a un dolor profundo en la región donde se ha producido la absorción, además de lesiones sistémicas. si el líquido penetra en los ojos, puede producir quemaduras graves. los vapores no poseen propiedades narcóticas serias, pero ejercen un efecto irritante sobre las mucosas y el sistema respiratorio cuando se inhalan como contaminante atmosférico. su presencia en una atmósfera industrial puede causar lagrimeo, dolor en los ojos y visión borrosa (necrosis de la córnea, hematuria y nefritis).
alcoholes amílicos:
los alcoholes pentílicos se presentan en varias formas isoméricas, y de las ocho estructuras isoméricas posibles, tres de ellas tienen también formas ópticamente activas. de las formas estructurales, cuatro de ellas son alcoholes primarios— 1-pentanol (alcohol amílico), 2-metil-1-butanol, alcohol isopentílico (3-metil-1-butanol, alcohol isoamílico) y alcohol neopentílico (2,2-dimetil-1-propanol); tres son alcoholes secundarios— 2-pentanol, 3-pentanol y 3-metil-2-butanol; y el último es un alcohol terciario—el alcohol terc-pentílico (2-metil-2-butanol).
el alcohol pentílico irrita las mucosas de los ojos, la nariz y la garganta cuando alcanza concentraciones de 100 ppm. si bien se absorbe por vía digestiva, respiratoria y cutánea, la incidencia de enfermedades profesionales es muy baja. el producto crudo causa rápidamente irritación de las mucosas debido a la presencia de materiales volátiles extraños. los síntomas de enfermedad generalizada son cefalea, mareo, náuseas, vómitos, diarrea, delirio y narcosis. el hecho de que el alcohol pentílico se utilice con frecuencia en estado impuro y mezclado con otros disolventes, hace imposible atribuir a este alcohol síntomas o hallazgos distintivos. la facilidad con la que se metabolizan los alcoholes decrece de los alcoholes primarios a los secundarios y terciarios. de los tres, los alcoholes terciarios son los que más se excretan sin sufrir cambios. aunque la toxicidad varía según la configuración química, puede afirmarse, en términos generales, que una mezcla de alcoholes pentílicos es aproximadamente diezveces más tóxica que el alcohol etílico. este hecho se refleja en los límites de exposición recomendados para los dos alcoholes—100 ppm y 1.000 ppm, respectivamente. el riesgo de incendio de los alcoholes amílicos no es particularmente elevado.
- BENEFICIOS DEL ALCOHOL
Previene enfermedades del corazón:
- Se dice que los antioxidantes en el vino tinto ayudan a la salud del corazón y el sistema cardiovascular. Las personas activas, que consumen por lo menos una bebida alcohólica a la semana, tienen un 50% menos de probabilidades de desarrollar una enfermedad cardíaca que una persona que se pasa todo el día frente al televisor.
Aumenta el colesterol 'bueno':
- La cerveza y el vino pueden aumentar el nivel de lipoproteínas de alta densidad (HDL, en inglés) que son capaces de retirar el colesterol de las arterias y transportarlo de vuelta al hígado para su excreción, lo que ayuda a evitar enfermedades como la arteriosclerosis. Sin embargo, hay que tener cuidado con las calorías de la cerveza, especialmente las de las oscuras; el abdomen podría sufrir las consecuencias.
Reduce la artritis:
- El alcohol puede disminuir considerablemente las posibilidades de contraer artritis en la vejez. Sin embargo, su consumo excesivo pude aumentar el riesgo de desarrollar la osteoporosis. Así, mientras una copa de vino puede evitar el dolor persistente de los huesos, también puede volverlos más propensos a romperse como ramitas. La solución: un 'ruso blanco', un cóctel de vodka con leche, que podría ayudar a los huesos de las dos maneras.
Aumenta la fibra:
- Al derivar de granos, la cerveza es realmente una fuente de buena fibra dietética, buena para aliviar algunos problemas de estreñimiento, hemorroides, diverticulosis y síndrome de intestino (colon) irritable. De hecho, medio litro (unas dos tazas) de cerveza puede proporcionar más de un cuarto de su ingesta diaria necesaria de fibra. Pero tenga cuidado, demasiada fibra puede conducir a visitar el inodoro más veces de lo debido.
- Previene ciertos tipos de cáncer:
Así es, incluso una amenaza de recaída y muerte por ciertos tipos de cáncer se puede reducir con unos pocos pero generosos tragos de vino. Para ser específicos, la enfermedad de Hodgking y el cáncer de riñón podrán ser combatidos, incluso se podrán prevenir, con un poco de vino tinto.
Previene enfermedades neurológicas:
Según algunos estudios, tomar un poco de alcohol de vez en cuando puede ayudar a prevenir el mal de Alzheimer y accidentes cerebrovasculares. Las proteínas de las vainas de mielina, que ayudan a proteger las vías neurológicas en el sistema nervioso, responden positivamente al alcohol. Por supuesto, el exceso provoca la muerte de las células del cerebro, por lo que una vez más, la moderación es la clave.
Salva vidas:
- Así es, pero de una manera muy particular. En caso de que, por alguna razón, llegara a ingerir anticongelante, una maratón de tragos de vodka o whisky puede salvarle la vida. ¡Es verdad! El alcohol actúa anulando los efectos peligrosos del etilenglicol, el componente principal en los anticongelantes.
Previene enfermedades del corazón:
Aumenta el colesterol 'bueno':
Reduce la artritis:
Aumenta la fibra:
Así es, incluso una amenaza de recaída y muerte por ciertos tipos de cáncer se puede reducir con unos pocos pero generosos tragos de vino. Para ser específicos, la enfermedad de Hodgking y el cáncer de riñón podrán ser combatidos, incluso se podrán prevenir, con un poco de vino tinto.
Previene enfermedades neurológicas:
Según algunos estudios, tomar un poco de alcohol de vez en cuando puede ayudar a prevenir el mal de Alzheimer y accidentes cerebrovasculares. Las proteínas de las vainas de mielina, que ayudan a proteger las vías neurológicas en el sistema nervioso, responden positivamente al alcohol. Por supuesto, el exceso provoca la muerte de las células del cerebro, por lo que una vez más, la moderación es la clave.
Salva vidas:
NOMBRE Y ESTRUCTURAS:

- BIBLIOGRAFIA DE LOS ALCOHOLES
http://www.facmed.unam.mx/deptos/salud/censenanza/spivst/2012/104-03.pdf
http://www.salonhogar.net/quimica/nomenclatura_quimica/Propiedades_alcoholes.htm
http://alcoholesquimica.blogspot.com/2010/10/usos-del-alcohol.html
http://actualidad.rt.com/ciencias/view/41647-Siete-razones-por-que-alcohol-es-bueno-para-salud
http://www.sabelotodo.org/quimica/alcoholes.html
ETERES
En química orgánica y bioquímica, un éter es un grupo funcional del tipo R-O-R', en donde R y R' son grupos alquilo, estando el átomo de oxígeno unido y se emplean pasos intermedios:ROH + HOR' → ROR' + H2O
Normalmente se emplea el alcóxido, RO-, del alcohol ROH, obtenido al hacer reaccionar al alcohol con una base fuerte. El alcóxido puede reaccionar con algún compuesto R'X, en donde X es un buen grupo saliente, como por ejemplo yoduro o bromuro. R'X también se puede obtener a partir de un alcohol R'OH.
PROPIEDADES FISICAS Y QUIMICAS DE LOS ETERES
Estructuralmente los éteres pueden considerarse derivados del agua o alcoholes, en los que se han reemplazado uno o dos hidrógenos, respectivamente, por restos carbonados.
La estructura angular de los éteres se explica bien asumiendo una hibridación sp3 en el oxígeno, que posee dos pares de electrones no compartidos,no puede establecer enlaces de hidrógeno consigo mismo y sus puntos de ebullición y fusión son muchos más bajos que los alcoholes referibles.
Un caso muy especial lo constituyen los epóxidos, que son éteres cíclicos de tres miembros. El anillo contiene mucha tensión, aunque algo menos que en el ciclo propano.
Ciclo propano
Epóxido de etilenoDebido a que el ángulo del enlace C-o-C no es de 180º, los momentos dipolares de los dos enlaces C-O no se anulan; en consecuencia, los éteres presentan un pequeño momento dipolar neto (por ejemplo, 1.18 D para el dietil éter).
PROPIEDADES QUÍMICAS:
Los éteres tienen muy poca reactividad química, debido a la dificultad que presenta la ruptura del enlace C—O. Por ello, se utilizan mucho como disolventes inertes en reacciones orgánicas.
En contacto con el aire sufren una lenta oxidación en la que se forman peróxidos muy inestables y poco volátiles. Estos constituyen un peligro cuando se destila un éter, pues se concentran en el residuo y pueden dar lugar a explosiones. Esto se evita guardando el éter con hilo de sodio o añadiendo una pequeña cantidad de un reductor (SO4Fe, LiAIH4) antes de la destilación.
Los éteres no son reactivos a excepción de los epóxidos. Las reacciones de los epóxidos pasan por la apertura del ciclo. Dicha apertura puede ser catalizada por ácido o apertura mediante nucleófilo.
(Apertura catalizada por ácido) El nucleófilo ataca al carbono más sustituido.
( Apertura por neoclófilo) El neoclófilo ataca al carbono menos sustituido.
En contacto con el aire sufren una lenta oxidación en la que se forman peróxidos muy inestables y poco volátiles. Estos constituyen un peligro cuando se destila un éter, pues se concentran en el residuo y pueden dar lugar a explosiones. Esto se evita guardando el éter con hilo de sodio o añadiendo una pequeña cantidad de un reductor (SO4Fe, LiAIH4) antes de la destilación.
Los éteres no son reactivos a excepción de los epóxidos. Las reacciones de los epóxidos pasan por la apertura del ciclo. Dicha apertura puede ser catalizada por ácido o apertura mediante nucleófilo.
Usos industriales de los éteres
- Anestésicos.
- Medio de arrastre para la deshidratacion de alcoholes isopropilicos y etílicos.
- Disolvente de sustacias orgánicas (aceites, grasas, resinas, nitrocelulosa, perfumes y alcaloides).
- Combustible inicial de motores diésel.
- Fuertes pegamentos.
- Antinflamatorio abdominal para después del parto, solo uso externo.
Beneficios y riesgos de los Eteres
Los éteres de polibromodifenilos (PBDEs) son sustancias químicas que retardan el fuego y que se agregan a productos de plástico y de espumas para hacer más difícil que se incendien. Hay diferentes tipos de PBDEs; algunos solamente tienen unos pocos átomos de bromo, mientras que otros tienen hasta diez átomos de bromo unidos a la molécula central.
Los PBDEs existen en forma de mezclas de compuestos químicos similares. Debido a que sólo se mezclan con los plásticos y espumas en vez de unirse a ellos, pueden escapar de los productos que los contienen y entrar al medio ambiente.
¿Qué les sucede a los PBDEs cuando entran al medio ambiente?
•Los PBDEs entran al aire, al agua y al suelo durante su manufactura y uso en productos de consumo.
•En el aire, los PBDEs pueden encontrarse como partículas que eventualmente se depositan en el suelo o el agua.
•La luz solar puede degradar algunos PBDEs.
•Los PBDEs no se disuelven fácilmente en agua, pero se adhieren a partículas y se depositan en el fondo de ríos o lagos.
•Algunos PBDEs pueden acumularse en peces, aunque generalmente en bajas concentraciones.
Regrese al comienzo de la página.
¿Cómo puede ocurrir la exposición a los PBDEs?
•Las concentraciones de PBDEs en la sangre, leche materna y tejido graso de seres humanos indican que la mayoría de la gente está expuesta a concentraciones bajas de PBDEs.
•Usted puede estar expuesto a los PBDEs a través del consumo de alimentos o inhalación de aire contaminados con PBDEs.
•Los trabajadores que manufacturan PBDEs o productos que contienen PBDEs pueden estar expuestos a niveles más altos que lo normal.
•También puede ocurrir exposición ocupacional en personas que trabajan en espacios cerrados en donde se reparan o reciclan productos que contienen PBDEs.
Regrese al comienzo de la página.
¿Cómo pueden afectar mi salud los PBDEs?
No hay información definitiva acerca de los efectos de los PBDEs sobre la salud de seres humanos. Las ratas y ratones que comieron alimentos con cantidades moderadas de PBDEs durante unos días sufrieron alteraciones de la glándula tiroides. Aquellos que comieron cantidades más pequeñas durante semanas o meses sufrieron alteraciones de la tiroides y el hígado. En estudios en animales se han observado diferencias marcadas entre los efectos de PBDEs con alto contenido de bromo y los con bajo contenido de bromo.
Hay evidencia preliminar que sugiere que concentraciones altas de PBDEs pueden producir alteraciones del comportamiento y afectar el sistema inmunitario de animales.
¿Qué posibilidades hay de que los PBDEs produzcan cáncer?
No sabemos si los PBDEs pueden producir cáncer en seres humanos. Las ratas y ratones que comieron de por vida alimentos con éter de decabromobifenilo (un tipo de PBDE) desarrollaron tumores en el hígado. Basado en esta evidencia, la EPA ha clasificado al éter de decabromobifenilo como posiblemente carcinogénico en seres humanos. La EPA ha determinado que los PBDEs con menos átomos de bromo que el éter de decabromobifenilo no son clasificables en cuanto a carcinogenicidad en seres humanos debido a la falta de estudios de cáncer en seres humanos y en animales.
¿Cómo pueden los PBDEs afectar a los niños?
Los niños generalmente están expuestos a los PBDEs de la misma manera que los adultos, principalmente al comer alimentos contaminados. Debido a que los PBDEs se disuelven fácilmente en la grasa, pueden acumularse en la leche materna y puede ser transferidos a bebés que lactan.La exposición a los PBDEs en el útero y a través de la leche materna ha producido alteraciones de la tiroides y del comportamiento en animales recién nacidos, pero no ha producido defectos de nacimiento. No se sabe si los PBDEs pueden producir defectos de nacimiento en seres humanos.
¿Cómo pueden las familias reducir el riesgo de exposición a los PBDEs?
•A los niños que viven cerca de sitios de desechos peligrosos se les debe aconsejar no jugar en la tierra cerca de estos sitios. También se les debe enseñar a no comer tierra y a lavarse las manos con frecuencia.
•Las personas que están expuestas a los PBDEs en el trabajo deben ducharse y cambiar de ropa cada día antes de volver al hogar. La ropa de trabajo debe guardarse y lavarse en forma separada de la ropa del resto de la familia.
Nombre y estructura de los componentes mas representativos de los eteres
1. Estructura y nomenclatura de los éteres
Los éteres son compuestos de fórmula general R-O-R, Ar-O-R o Ar-O-Ar.Para designar los éteres, por lo general se indican los dos grupos unidos al oxígeno, seguidos de la palabra éter:
simple de los éteres aril alquílicos, el metil fenil éter, tiene el nombre especial de anisol.
BIBLIOGRAFIA DELOS ETERES
http://es.wikipedia.org/wiki/%C3%89ter_(qu%C3%ADmica)
http://avilaherrera.blogspot.com/2010/09/usos-principales.html
http://espanol.answers.yahoo.com/question/index?qid=20100518192545AATmuo5http://organica1.org/qo1/ok/eteres/eter1.htm
ESTERES
Los Ésteres son compuestos orgánicos derivados de ácidos orgánicos o inorgánicos oxigenados en los cuales uno o más protones son sustituidos por grupos orgánicos alquilo (simbolizados por R').
Etimológicamente, la palabra "éster" proviene del alemán Essig-Äther (éter de vinagre), como se llamaba antiguamente al acetato de etilo.
En los ésteres más comunes el ácido en cuestión es un ácido carboxílico. Por ejemplo, si el ácido es el ácido acético, el éster es denominado como acetato. Los ésteres también se pueden formar con ácidos inorgánicos, como el ácido carbónico (origina ésteres carbónicos), el ácido fosfórico (ésteres fosfóricos) o el ácido sulfúrico. Por ejemplo, el sulfato de dimetilo es un éster, a veces llamado "éster dimetílico del ácido sulfúrico
Un ensayo recomendable para detectar ésteres es la formación de hidroxamatos férricos, fáciles de reconocer ya que son muy coloreados:
- Ensayo del ácido hidroxámico: la primera etapa de la reacción es la conversión del éster en un ácido hidroxámico (catalizado por base). En el siguiente paso éste reacciona con cloruro férrico produciendo un hidroxamato de intenso color rojo-violeta.
- En bioquímica son el producto de la reacción entre los ácidos grasos y los alcoholes.
- En la formación de ésteres, cada radical OH (grupo hidroxilo) del radical del alcohol se sustituye por la cadena -COO del ácido graso. El H sobrante del grupo carboxilo, se combina con el OH sustituido, formando agua.
- En química orgánica y bioquímica los ésteres son un grupo funcional compuesto de un radical orgánico unido al residuo de cualquier ácido oxigenado, orgánico o inorgánico.
- Los ésteres más comúnmente encontrados en la naturaleza son las grasas, que son ésteres de glicerina y ácidos grasos (ácido oleico, ácido esteárico, etc.)
Principalmente resultante de la condensación de un ácido carboxílico y un alcohol. El proceso se denomina esterificación:
- Un éster cíclico es una lactona.
PROPIEDADES FISICAS Y QUIMICAS DE LOS ESTERES
Al tratarse de compuestos moleculares (líquidos volátiles o sólidos) sus propiedades físicas más representativas son:
Aislantes eléctricos en fusión y en disolución.
Bajo temperatura de fusión y ebullición que crece con la masa molar. Las propiedades físicas y químicas de los ésteres de bajo peso molecular corresponden, en general, a una combinación de las propiedades de los dos grupos. Al aumentar el peso molecular, la parte de hidrocarburo de la molécula tiene un efecto preponderante sobre las funciones oxigenadas, razón por la cual los ésteres superiores son ceras sólidas, blandas e insolubles en agua.
Según la longitud de la cadena hidrocarbonada serán más o menos solubles en agua y más o menos solubles en disolventes orgánicos (hexano, éter, benceno, acetona…)
A causa del número extraordinariamente elevado de ácidos y alcoholes que pueden utilitzarse en la reacción de esterificación, se han preparado y estudiado miles de ésteres, desde el más sencillo (HCOOCH3, formiato de metilo), hasta los compuestos de peso molecular más elevado que contienen 30 o más átomos de carbono en ambas partes de la molécula.
PROPIEDADES QUIMICAS:
En las reacciones de los ésteres, la cadena se rompe siempre en un enlace sencillo, ya sea entre el oxígeno y el alcohol o R, ya sea entre el oxígeno y el grupo R-CO-, eliminando así el alcohol o uno de sus derivados.
La saponificación de los ésteres, llamada así por su analogía con la formación de jabones a partir de las grasas, es la reacción inversa a la esterificación: Los ésteres se hidrogenan más fácilmente que los ácidos, empleándose generalmente el éster etílico tratado con una mezcla de sodio y alcohol, y se condensan entre sí en presencia de sodio y con las cetonas.
USOS DE LOS ESTERES
Disolventes
Los ésteres de bajo peso molecular son líquidos y se acostumbran a utilizar como disolventes, especialmente los acetatos de los alcoholes metílico, etílico y butílico.
Plastificantes
El acetatopropionato de celulosa y el acetatobutirato de celulosa han conseguido gran importancia como materiales termoplásticos. El nitrato de celulosa con un contenido de 10,5-11% de nitrógeno se llama piroxilina y con alcohol y alcanfor (plastificante) forma el celuloide. El algodón dinamita es nitrato de celulosa con el 12,5-13,5% de nitrógeno. La cordita y la balistita se fabrican a partir de éste, que se plastifica con trinitrato de glicerina (nitroglicerina). Los sulfatos de dimetilo y dietilo (ésteres del ácido sulfúrico) son excelentes agentes de alcoholización de moléculas orgánicas que contienen átomos de hidrógeno lébiles, como por ejemplo, el midón y la celulosa.
Aromas artificiales
Muchos de los ésteres de bajo peso molecular tienen olores característicos a fruta: plátano (acetado de isoamilo), ron (propionato de isobutilo) y piña (butirato de butilo). Estos ésteres se utilizan en la fabricación de aromas y perfumes sintéticos.
Aditivos Alimentarios
Estos mismos ésteres de bajo peso molecular que tienen olores característicos a fruta se utilizan como aditivos alimentarios, por ejemplo, en caramelos y otros alimentos que han de tener un sabor afrutado.
Productos Farmacéuticos
Productos de uso tan frecuente como los analgésicos se fabrican con ésteres.
Polímeros Diversos
Los ésteres de los ácidos no saturados, por ejemplo, del ácido acrílico o metacrílico, son inestables y se polimerizan rápidamente, produciendo resina; así, el metacrilato de metilo (lucita o plexiglás). De manera análoga los ésteres de los alcoholes no saturados son inestables y reaccionan fácilmente con ellos mismos; así, el acetado de vinilo se polimeriza dando acetato de polivinilo. Las resinas de poliéster, conocidas como gliptales, resultan de la poliesterificación de la glicerina con anhídrido ftálico; el proceso puede controlarse de manera que se produzca una resina fusible o infusible. Cuando la poliesterificación se realiza en presencia de un ácido no saturado de cadena larga del tipo de los aceites secantes, la polimerización de éste por oxidación se superpone a la poliesterificación y se producen los esmaltes sintéticos, duros y resistentes a la intemperie, que son muy adecuados por el acabado de los automóviles. La poliesterificación del etilenglicol con el ácido tereftálico produce fibra de poliéster. Si se da forma de láminas a este material, constituye una excelente película fotográfica.
Repelentes de insectos
Todos los repelentes de insectos que podemos encontrar en el mercado contienen ésteres.
BENEFICIOS PARA LA SALUD DE LOS ESTERES
Numerosos beneficios de los ésteres etílicos del ácido Omega 3Omega 3 ácido etil ésteres es el nombre dado a las grasas poliinsaturadas que son buenas para la salud. Estas grasas están obligadas a reducir los niveles de triglicéridos en el cuerpo, lo que controla los niveles de colesterol malo y prevención de enfermedades del corazón y paro cardíaco súbito.
Hay numerosos otros beneficios del consumo de ésteres de omega 3 ácido etílico en forma de cápsulas. Estas cápsulas son fabricadas mediante el uso de aceite de pescado, que es una de las fuentes más ricas y más saludables, particularmente DHA y EPA.
Los beneficios más notables del consumo de estos se observan en el contexto de la prevención de ciertas enfermedades como el cáncer y la enfermedad de Alzheimer. Además, también son buenos para la promoción de la salud general y salud mental particular. Ésteres de Omega 3 prevenir la depresión y la ansiedad y otros trastornos mentales relacionadas con la salud.
Los médicos han reconocido los beneficios de salud asociados con el consumo de cápsulas de aceite de pescado. Recomiendan estos suplementos a personas de todas las edades, especialmente las mujeres embarazadas, niños y ancianos.
Cápsulas son buenos para reducir la inflamación en todo el cuerpo. Dichas medidas pueden adoptarse en condiciones inflamatorias como artritis, cistitis y prostatitis. Normalmente de 3 a 4 porciones de un suplemento nutricional de omega 3 son recomendadas por los médicos. Sin embargo, si usted es deficiente, puede incrementar esta dosis.
Suplementos de omega líquido también pueden añadirse a la dieta diaria para recibir una cantidad adecuada de DHA y EPA. 1 cucharada de aceite de pescado líquido es suficiente después de cada comida. Estos suplementos son excelentes para los niños y los ancianos ya que son muy fáciles de consumir y digerir.
Algunas fuentes de alimentos que contienen ésteres de omega 3 ácido etílico son aceite de linaza, aceite de cáñamo, aceite de maíz, soya, frijoles, queso de soja, nueces y camarones. Huevos Omega 3 enriquecido también están disponibles ahora que proporcionan buenas cantidades de DHA y EPA. Usted debe también consumir pescado al menos dos veces a la semana para obtener su parte de los ácidos grasos saludables.
Si usted está buscando en línea los suplementos, es aconsejable para encontrar los hechos con alto grado o aceite de calidad farmacéutica. Este aceite es refinado y purificada a través de un proceso conocido como destilación molecular y es apto para el consumo.
Suplementos de Omega-3 no causan efectos secundarios, pero si tiene infecciones o alergias es aconsejable acudir al médico inmediatamente.
RIESGOS PARA LA SALUD DE LOS ESTERES
Los estudios han mostrado daños en el hígado, riñones, pulmones y testículos. Por otra parte, un estudio japonés publicado en 2006 realizado con primates jóvenes no ha encontrado daños testiculares de ningún tipo. El Instituto de Sanidad y Protección al Consumidor de la Oficina Química Europea ha encontrado que dos de los ftalatos considerados peligrosos para el hombre y prohibidos en la UE (el DINF o diisononilftalato y el DIDP o diisodecilftalato) no suponen un riesgo para la salud humana o para el medio ambiente en su formas de uso actuales.
También causa confusión en animales como roedores.El MINISTERIO DE SALUD ha tomado conocimiento de la posible existencia de riesgos para la salud de los niños menores de (TRES) 3 años por el empleo de ésteres de ácido ftálico como plastificantes en la fabricación de mordillos y otros artículos de puericultura, así como de juguetes que puedan ser mordidos o chupados.
Que si bien se reconoce que existen diversas fuentes de exposición a los ésteres de ácido ftálico tales como el aire, el ambiente, el agua de bebida y los alimentos, ante la posibilidad de que tengan efectos adversos sobre la salud el COMITE CIENTIFICO SOBRE TOXICIDAD, ECOTOXICIDAD Y MEDIO AMBIENTE de la UNION EUROPEA ha recomendado la adopción de medidas precautorias de restricción en el uso de ésteres de ácido ftálico en mordillos y juguetes pasibles de ser mordidos, destinados a niños menores de (TRES) 3 años.
Que hasta la fecha no se ha validado un método de migración específica de los ésteres de ácido ftálico a partir de los materiales que los contienen, bajo condiciones reales de uso, lo que impide el establecimiento de límites admisibles para la migración de los ésteres de ácido ftálico en juguetes y artículos de puericultura.
Que en ejercicio de la capacidad del Estado Nacional para determinar los requisitos esenciales de seguridad que deben cumplir los productos de venta libre y/o de uso masivo para garantizar a la población que las sustancias empleadas no comprometen su seguridad en condiciones previsibles de uso, el MINISTERIO DE SALUD dictó la Resolución N° 978/99.
Que atendiendo a que en otros países de la región carecen de iguales restricciones a estos productos y siendo la REPUBLICA ARGENTINA territorio de tránsito directo comercial entre algunos de ellos, el MINISTERIO DE SALUD por Resolución N° 268 de fecha 17 de abril de 2000 hizo inaplicable los términos de la Resolución N° 978/99 a la mercadería que arribe al territorio aduanero en tránsito directo con destino al exterior.
Que el 5 de septiembre próximo pasado la Comisión Europea prolongó por tercera vez la validez de la Decisión 1998/815/CE sobre medias relativas a la prohibición de la comercialización de juguetes y artículos de puericultura destinados a ser llevados a la boca.
Que si bien la restricción impuesta acota significativamente el riesgo a que están expuestos los niños menores de tres años, también es sabido que en esta etapa de la vida los niños presentan una fuerte tendencia a llevarse a la boca todo tipo de objetos, y no sólo aquellos diseñados a tal efecto, por lo que aparece conveniente establecer un procedimiento que permita identificar a los artículos dirigidos a este grupo etario que contengan los ésteres de ácido ftálico definidos como riesgosos para la salud.
NOMBRE Y ESTRUCTURA QUIMICA DE LOS ESTERES
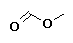
Metanoato de metilo
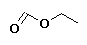
Metanoato de etilo
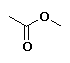
Etanoato de metilo
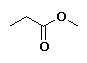
Propanoato de metilo
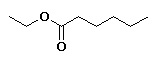
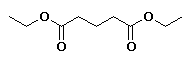
hexanoato de etilo
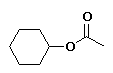
etanoato de ciclohexilo
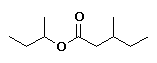
3-metilpentanoato de 2-butilo
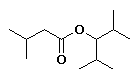
3-metilbutanoato de 2,4-dimetil-3-pentilo
BIBLIOGRAFIA
















.jpg)














.jpg)


.jpg)
.jpg)
No hay comentarios:
Publicar un comentario