ALDEHÍDOS
Los aldehídos son compuestos orgánicos caracterizados por poseer el grupo funcional -CHO. Se denominan como los alcoholes correspondientes, cambiando la terminación -ol por -al. Etimológicamente, la palabra aldehído proviene del latín científico alcohol dehydrogenatum
Propiedades Físicas
A temperatura de 25ºC, los aldehídos con uno o dos carbonos son gaseosos, de 3 a 11 carbonos son líquidos y los demás son sólidos. Los aldehídos más simples son bastante solubles en agua y en algunos solventes apolares.
Presentan también olores penetrantes y generalmente desagradables. Con el aumento de la masa molecular esos olores van volviéndose menos fuertes hasta volverse agradables en los términos que contienen de 8 a 14 carbonos. Algunos de ellos encuentran inclusive su uso en perfumería (especialmente los aromáticos).El grupo carboxilo confiere una considerable polaridad a los aldehídos y por esto poseen puntos de ebullición más altos que otros compuestos de peso molecular comparable.
Mientras tanto, no se forman enlaces de hidrógeno intermoleculares, visto que ellos contienen apenas hidrógeno enlazado al carbono. Comparándose las cetonas con los aldehídos isómeros, las cetonas tienen punto de ebullición más elevado y son más solubles en agua, pues sus moléculas son más polares que las de los aldehídos.
Propiedades químicas
Los aldehídos y cetonas son bastante reactivos en ocurrencia de gran polaridad generada por el grupo carboxilo, que sirve como lugar de adición nucleofílica y aumentando la acidicidad de los átomos de hidrógeno ligados al carbono α ,En relación a las cetonas, los aldehídos son bastante más reactivos. Como el grupo carbonilo confiere a la molécula una estructura plana y la adición de un reactivo nucleofílico puede ocurrir en dos lugares, osea, la superficie de contacto es mayor, lo que facilita la reacción.
Otros factores influencian la reactividad de los aldehídos son las intensidad de la polaridad entre C y O y el volumen de los agrupamientos enlazados al carboxilo.
Los grupos de mayor inducción disminuyen la deficiencia electrónica en el carbono y consecuentemente disminuye la afinidad de este por reactivos nucleofílicos, o sea la reacción de adición nucleofílica es mas difícil.
Ya los grupos de menor inducción aumentan la deficiencia electrónica en el carbono y consecuentemente aumentan la afinidad de este por reactivos nucleofílicos, o sea, la reacción de adición nucleofílica es más fácil.
También la velocidad de la reacción crece proporcionalmente a la intensidad de la polaridad del grupo carboxilo, pues más intensa será la carga parcial positiva sobre el carbono, el mayor será su afinidad como el nucleofílico.
USOS DE LOS ALDEHIDOS
- La fabricación de resinas
- Plásticos
- solventes
- Pinturas
- Perfumes
- Esencias
Los aldehídos están presentes en numerosos productos naturales y grandes variedades deellos son de la propia vida cotidiana. Laglucosapor ejemplo existe en una forma abiertaque presenta un grupo aldehído.
El acetaldehídoformado como intermedio en lametabolización se cree responsable en gran medida de los síntomas de la resaca tras laingesta de bebidas alcohólicas.
El formaldehídoes un conservante que se encuentra en algunas composiciones de productos cosméticos
Sin embargo esta aplicación debe ser vista con cautela ya que enexperimentos con animales el compuesto ha demostrado un poder cancerígeno. También seutiliza en la fabricación de numerosos compuestos químicos como la baquelita, lamelaminaetc.
Los aldehídos están ampliamente presentes en la naturaleza. El importante carbohidrato glucosa,es un
polihidroxialdehíd La vanillina saborizante principal de la vainilla es otro ejemplo dealdehído natural.Probablemente desde el punto de vista industrial el mas importante de los aldehídos sea elformaldehído, un gas de olor picante y medianamente tóxico, que se usa en grandes cantidadespara la producción de plásticos termoestables como la bakelita.La solución acuosa de formaldehído se conoce como formol o formalina y se usa ampliametecomo desinfectante, en la industria textil y como preservador de tejidos a la descomposición.
Los aldehídos están ampliamente presentes en la naturaleza. El importante carbohidrato glucosa,es un
polihidroxialdehíd La vanillina saborizante principal de la vainilla es otro ejemplo dealdehído natural.Probablemente desde el punto de vista industrial el mas importante de los aldehídos sea elformaldehído, un gas de olor picante y medianamente tóxico, que se usa en grandes cantidadespara la producción de plásticos termoestables como la bakelita.La solución acuosa de formaldehído se conoce como formol o formalina y se usa ampliametecomo desinfectante, en la industria textil y como preservador de tejidos a la descomposición.
BENEFICIOS Y RIESGOS PARA LA SALUD
La mayor parte de los aldehídos pueden causar irritación de la piel, los ojos y el sistema respiratorio, siendo este efecto más pronunciado en los miembros inferiores de una serie, en los miembros con la cadena alifática insaturada y en los miembros con sustitución halógena. Los aldehídos pueden tener un efecto anestésico, pero las propiedades irritantes de algunos de ellos posiblemente obligen al trabajador a limitar la exposición antes de que ésta sea suficiente como para que se manifiesten los efectos anestésicos. El grado de toxicidad varía mucho en esta familia. No obstante, otros miembros de la familia son cancerígenos conocidos o sospechosos y exigen la adopción de medidas de precaución siempre que exista posibilidad de contacto con ellos. Algunos son mutágenos químicos y otros, alergenos. También tienen la capacidad de producir un efecto hipnótico.
COMPUESTOS MAS RPRESENTATIVOS
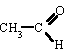
etanal
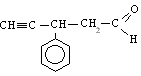
3-fenil-4-pentinal
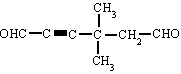
4,4-dimetil-2-hexinodial
BIBLIOGRAFIA
http://profesionseg.blogspot.com/2007/10/riesgos-para-la-salud-de-los-aldehidos.html
http://es.scribd.com/doc/29517247/Usos-de-Los-Aldehidos
http://quimica.laguia2000.com/general/propiedades-de-los-aldehidos
http://quimica.laguia2000.com/general/propiedades-de-los-aldehidos
CETONAS
El grupo funcional carbonilo consiste en un átomo de carbono unido con un doble enlace covalente a un átomo de oxígeno.
Propiedades físicas
Las cetonas hasta un tamaño de 10 carbonos son líquidas. Por encima de 10 carbonos son sólidos.
Las primeras tienen un olor particular agradable, las siguientes son de olor fuerte desagradable y las superiores son inodoras.
Las alifáticas son todas menos densas que el agua. La propanona presenta solubilidad en agua, las otras son poco solubles. Si son solubles en éter, cloroformo, etc…
Propiedades Químicas
Reacciones de adición
Adición de Hidrógeno:Al igual que los aldehídos, las cetonas pueden adicionar átomos de hidrógeno en presencia de catalizadores.
Con halógenos dan reacciones de sustitución:
Quinonas:
Son un tipo especial de cetonas que derivan del benceno. Dos átomos de hidrógeno son reemplazados por dos de oxígeno. En el anillo quedan dos dobles enlaces.
USOS DE LAS CETONAS
Las cetonas son usadas en varios aspectos de la vida diaria, pero la más común y usada es la ACETONA,
lo creamos o no, las cetonas se encuentra en una gran variedad de materiales en la que nosotros no nos damos cuenta ni si quiera de que estamos sobre ellas.
Algunos ejemplos de los usos de las cetonas son las siguientes:
.- Fibras Sintéticas (Mayormente utilizada en el interior de los automóviles de gama alta)
.-Solventes Industriales (Como el Thiner y la ACETONA)
.-Aditivos para plásticos (Thiner)
.-Fabricación de catalizadores
.-Fabricación de saborizantes y fragancias
.-Síntesis de medicamentos
.-Síntesis de vitaminas
.-Aplicación en cosméticos
..Adhesivos en base de poliuretano
BENEFICIOS Y RIESGOS PARA LA SALUD
- la penetración en el organismo se realiza de forma fundamental a través de la via respiratoria y cutanea.
- irritante de la mucosa ocular y vias respiratorias
- dermatitis irritativa. efecto depresor del s.n.c.
- trastornos digestivos. neuropatia periferica.
- irritacion de las vias respiratorias
- sintomás anestesicos (desorientacion, depresion, perdida de conocimiento, cefaleas, mareos, vomitos)
- efectos crónicos de las cetonas: dermatitis (piel seca agrietada y eritematosa)
COMPUESTOS MAS REPRESENTATIVOS
1. CETONAS ALIFÁTICAS :
Isomería:
- Las cetonas son isómeros de los aldehídos de igual número de carbono.
- Las cetonas de más de cuatro carbonos presentan isomería de posición. (En casos específicos)
- Las cetonas presentan tautomería ceto-enólica.
Se destacan las quinonas, derivadas del benceno.
3. CETONAS MIXTAS :
3. CETONAS MIXTAS :
Cuando el grupo carbonil se acopla a un radical arilico y un alquilico, como el fenilmetilbutanona.
BIBLIOGRAFIA
http://www.quimicayalgomas.com/quimica-organica/alcoholes-aldehidos-cetonas/cetonas
http://www.elergonomista.com/cetonas.htm
.jpg)

.jpg)

.jpg)

.png)
.png)
.png)
.png)
.png)

.jpg)


































